ตัวอย่างการจัดเตรียมเอกสารสำหรับการตรวจประเมินสถานที่ผลิตเครื่องสำอาง (ภาคผนวก ก.)
ประกาศแจ้งเตือนไม่ให้ใช้ผลิตภัณฑ์เครื่องสำอางประเทศพม่า จำนวน 12 รายการ
สำนักงานคณะกรรมการอาหารและยา โดยศูนย์เฝ้าระวังความปลอดภัยด้านผลิตภัณฑ์สุขภาพ (Health Product Vigilance Center: HPVC) กองยุทธศาสตร์และแผนงาน ขอเรียนแจ้งข่าว เตือนภัยด้านผลิตภัณฑ์สุขภาพไปยังหน่วยงานเครือข่ายสาธารณสุขทั่วประเทศ ดังนี้
1.HIJA BUEAUTY/ Apple Lipstick พบสาร Rhodamine B
2. PEARL SKIN / Pearl & Ginger Cream พบสาร Mercury
3. ANYLADY / Pretty Girl MAKE UP PALETTE (eyeshadow/blusher/ highlighter/ lipstick/eyebrow powder) พบสาร Rhodamine B และ Lead
4. lameila / 16 COLOR EYESHADOW–01 พบสาร Lead
5. Lidanxiu / LIP STICK พบสาร Rhodamine B
6. Anylady/ 12 color Eyeshadow Palette(01) พบสาร Rhodamine B และ Lead
7. Collagen Plus Vit E / Day & Night Cream พบสาร Mercury
8. IMAN OF NOBLE / Liquid shadow fashion Eyeshadow(03) พบสาร Rhodamine B
9. MILA COLOR / PRIMER EYEBROW kit – 01 พบสาร Lead
10. IU Beauty / LIP GLOSS – 02 พบสาร Rhodamine B
11. Kiss Beauty / FASHION COLOUR MAKEUP KIT-2 พบสาร Rhodamine B และ Lead
12. L`CHEAR / To Love Sweet Make Up Kit-2 พบสาร Lead
การต่ออายุ ใบอนุญาตยา เพื่อใช้ในปี 2567
หนังสือราชการแจ้งเรื่องการต่ออายุ
- การต่ออายุใบอนุญาตเกี่ยวกับยา ยาเสพติดให้โทษในประเภท 3 วัตถุออกฤทธิ์ในประเภท 3 หรือประเภท 4 เพื่อใช้ในปี พ.ศ. 2567
- คำอธิบายเกี่ยวกับค่าธรรมเนียม ขั้นตอน ช่องทางการต่ออายุ
- ใบอนุญาตเกี่ยวกับยาเสพติดให้โทษในประเภท 3 วัตถุออกฤทธิ์ในประเภท 3 หรือประเภท 4 เนื่องจากยังไม่มีกฎกระทรวงเรื่องการต่ออายุ จึงยังไม่มีการต่ออายุในปีนี้
การตรวจประเมินตามวิธีการปฏิบัติทางเภสัชกรรมชุมชน (GPP) สำหรับร้านยา ข.ย. 1, 2, 3 และ 4
- ร้านยา ข.ย. 1 ที่ต้องยื่นตรวจประเมิน GPP ในปี 2566 มีเลขที่ใบอนุญาตดังนี้
**ยกเว้น ร้านยาคุณภาพ ไม่ต้องยื่นตรวจประเมิน ให้แสดงสำเนาหนังสือรับรองร้านยาคุณภาพแทน** - ร้านยา ข.ย. 2, 3 และ 4 ต้องยื่นตรวจประเมิน GPP ทุกร้าน
หากประสงค์ยื่นต่ออายุผ่านระบบ SKYNET ให้ตรวจสอบว่าร้านของท่านได้ยื่นคำขอตรวจ GPP / เป็นร้านยาคุณภาพที่ได้รับการรับรอง เรียบร้อยแล้ว จึงยื่นคำขอต่ออายุใน SKYNET หากพบว่าไม่ได้ยื่นการประเมินดังกล่าว จะคืนคำขอทันที
กรณีประสงค์ยื่นเอกสารต่ออายุเองที่ สสจ. สมุทรปราการ
- จองคิว ผ่านระบบออนไลน์ก่อนเข้ารับบริการ
- เตรียมเอกสารให้ครบถ้วน
กรณีต้องการแก้ไข / เปลี่ยนแปลงรายการในใบอนุญาต ต้องดำเนินการผ่านระบบ SKYNET เท่านั้น - ชำระเงินโดยการโอน / scan จ่าย ที่ OSSC ชั้น 1 ของกลุ่มงานคุ้มครองฯ
คู่มือผู้ประกอบการในการต่ออายุผ่านระบบอิเล็กทรอนิกส์ (SKYNET)
- การสมัครบัญชี Open ID
วีดีทัศน์ OpenID ของสำนักงานคณะกรรมการอาหารและยา - การเปิดสิทธิ์เข้าใช้งานระบบ อย
2.1 ผู้รับอนุญาตเป็นบุคคลธรรมดา เมื่อทำขั้นตอนที่ 1. แล้ว สามารถเข้าใช้งานระบบได้เลยโดยไม่ต้องเปิดสิทธิ์ (คลิกปุ่ม “ประชาชน“)
2.2 ผู้รับอนุญาตเป็นนิติบุคคล / ผู้รับอนุญาตบุคคลธรรมดามอบอำนาจ ผู้ดำเนินกิจการ (กรณีผู้รับอนุญาตเป็นนิติบุคคล) หรือผู้รับมอบอำนาจ จัดทำเอกสารขอเปิดสิทธิ์ ยื่นที่ สสจ. สมุทรปราการ หลังจากทำการเปิดสิทธิ์จึงจะเข้าใช้งานระบบ อย. ได้ โดยใช้ Username และ Password ในขั้นตอนที่ 1 (คลิกปุ่ม “ผู้ประกอบการ“)
เอกสารเปิดสิทธิ์ - การยื่นต่ออายุ
3.1 วิดีทัศน์ อธิบายการใช้ระบบต่ออายุ (***Update วันที่ 03/10/2566***)
3.2 คู่มือการต่ออายุสำหรับผู้ประกอบการ
ภาค 1 การตั้งค่าและการใช้งานทั่วไป
ภาคผนวก 6 ระบบการต่ออายุ - เอกสารที่ต้อง Scan เป็นไฟล์ PDF
4.1 ใบรับรองแพทย์ ระบุ 5 โรค ตามประกาศฯ ออกให้ไม่เกิน 3 เดือน
ของผู้รับอนุญาต/ ผู้ดำเนินกิจการ และผู้มีหน้าที่ปฏิบัติการทุกคน
4.2 คำรับรองของผู้มีหน้าที่ปฏิบัติการทุกคน
4.3 แผนที่ตั้งร้านยา
4.4 รูปถ่ายด้านหน้าสถานที่ที่ได้รับอนุญาต (เห็นป้ายชื่อสถานที่)
4.5 สำเนาหนังสือรับรองร้านยาคุณภาพที่อยู่ในอายุรับรอง (มากกว่าปี 2566) เฉพาะร้านยาคุณภาพ - เมื่อชำระเงินในระบบแล้ว จึงส่งเอกสาร ใบอนุญาต/ รูปถ่ายผู้ดำเนินกิจการ (ถ้าช่องเต็ม) /ชื่อ-ที่อยู่ที่ให้จัดส่งใบอนุญาต กลับให้ สสจ. ทางไปรษณีย์
Link ดาวน์โหลดแบบฟอร์มต่างๆ
งานยา การยื่นขออนุญาตด้านยา ผ่านระบบ E-submission

ขั้นตอนการขออนุญาตสถานที่ด้านยา (คำขอใหม่/แก้ไขเปลี่ยนแปลง) ผ่านระบบ SKYNET
- ลงทะเบียน OPEN ID https://accounts.egov.go.th
(หากมีปัญหาในการสมัครเพื่อสร้างบัญชีผู้ใช้งาน โปรดติดต่อ contact@dga.or.th หรือโทร 0 2612 6060) - ยื่นคำขอเปิดสิทธิ์เข้าใช้งานระบบสถานที่ด้านยา (ยื่นที่ สสจ.) (คลิก)
รายการเอกสารที่ใช้ ดังนี้
(1) หนังสือแจ้งความประสงค์ พร้อม สำเนา 1 ชุด
– กรณีผู้ดำเนินกิจการ ประสงค์เข้าใช้งานระบบด้วยตนเอง
– กรณีที่มอบอำนาจให้บุคคลอื่น เข้าใช้งานระบบแทน
(2) หนังสือมอบอำนาจสิทธิ์ระบบ skynet - วิธีการใช้งานระบบสถานที่ด้านยา
(1) คู่มือสำหรับผู้ประกอบการ การใช้งานระบบสถานที่ด้านยา
(2) Slides อบรมสถานที่ด้านยาสำหรับผู้ประกอบการ 7 มิ.ย. 66
(3) VDO คู่มือการใช้งานระบบ
- ขออนุมัติชื่อสถานที่ และแบบแปลนสถานที่ (ยื่นที่ สสจ. หรือปรึกษาทาง Line @fda11)
- จัดเตรียมสถานที่และป้ายตามกฎหมาย (ศึกษาหลักเกณฑ์การจัดเตรียมสถานที่)
- ยื่นคำขอผ่านระบบ SKYNET
** สามารถยื่นเอกสารคำขอใหม่ ในรูปแบบกระดาษ ที่ สสจ. เพื่อให้เจ้าหน้าที่พิจารณาความถูกต้องครบถ้วนก่อนยื่นในระบบ (นัดหมายล่วงหน้า) เอกสารทั้งหมดก่อนส่งเจ้าหน้าที่ ให้ scan เป็นไฟล์ PDF ไว้ยื่นในระบบ E-SUB ด้วย **
งานตรวจเฝ้าระวังสถานที่ผลิต/นำเข้า เครื่องสำอาง

ข่าว/ประกาศ ประชาสัมพันธ์…
หนังสือแจ้งการตรวจเฝ้าระวังสถานที่ผลิตเครื่องสำอางตามประกาศกระทรวงสาธารณสุข เรื่อง หลักเกณฑ์ วิธีการ และเงื่อนไขในการผลิตหรือนำเข้าเครื่องสำอาง พ.ศ. 2561 ภายใต้โครงการเครื่องสำอางปลอดภัย ประจำปีงบประมาณ 2567
📁แบบประเมินตัวเองสถานที่ผลิตเครื่องสำอาง (คลิก)
📁แบบประเมินตัวเองสถานที่นำเข้าและสถานที่เก็บเครื่องสำอาง(คลิก)

คู่มือแนวทางการตรวจสอบสถานที่ตามประกาศกระทรวงสาธารณสุข เรื่อง หลักเกณฑ์ วิธีการและเงื่อนไขในการผลิต หรือนำเข้าเครื่องสำอาง พ.ศ. 2561 (ฉบับปรับปรุง)
ตัวอย่างแบบบันทึก แบบฟอร์ม และตัวอย่างการจัดเตรียมเอกสารต่างๆ ของสถานที่ผลิตเครื่องสำอาง


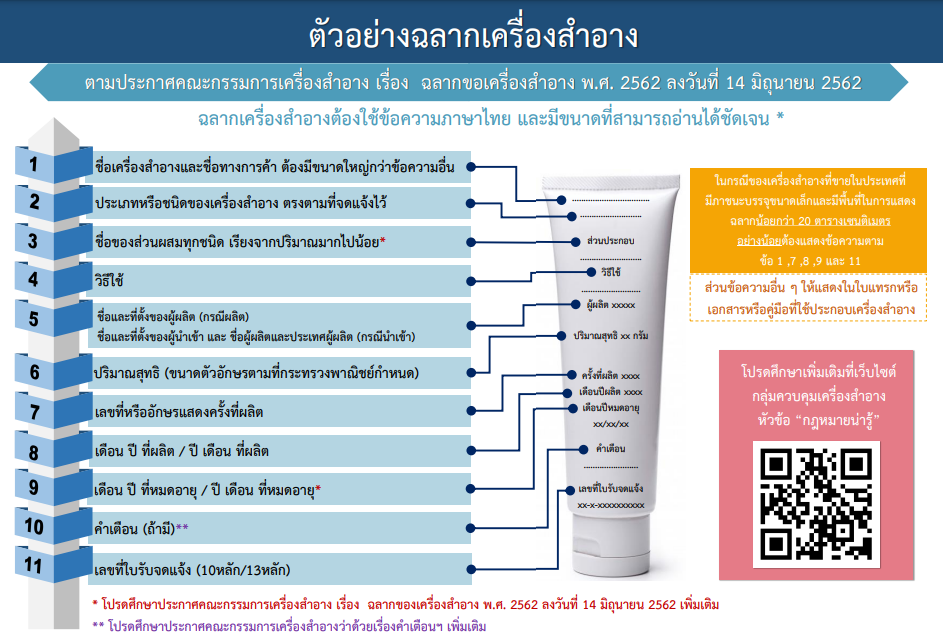
- ประกาศคณะกรรมการเครื่องสำอาง เรื่อง ฉลากของเครื่องสำอาง พ.ศ. 2562 (คลิก)
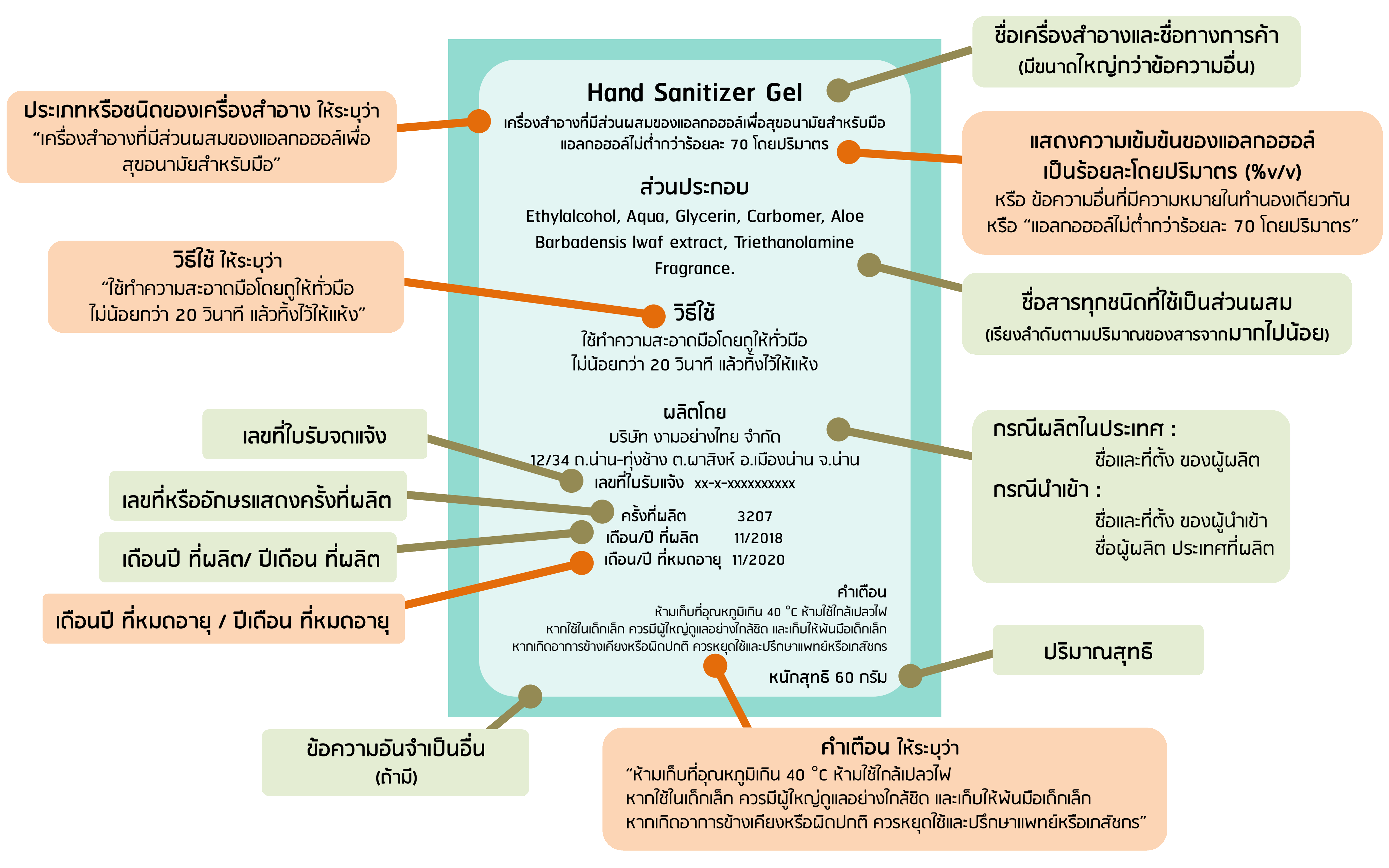
- ประกาศคณะกรรมการเครื่องสำอางเรื่อง ฉลากของเครื่องสำอางที่มีส่วนผสมของแอลกอฮอล์เพื่อสุขอนามัยสำหรับมือ พ.ศ.2563 (คลิก)
- แนวทางปฏิบัติและการแสดงฉลากเครื่องสำอางที่มีส่วนผสมของแอลกอฮอล์เพื่อสุขอนามัยสำหรับมือ ตั้งแต่ วันที่ ๙ มีนาคม ๒๕๖๓ เป็นต้นไป (สำหรับผู้ประกอบการ)
ตัวอย่างการทำฉลากเครื่องสำอางทั่วไป
ตัวอย่างการทำฉลากเครื่องสำอางที่มีส่วนผสมของแอลกอฮอล์เพื่อสุขอนามัยสำหรับมือ